(ENEM PPL - 2019)O gs hidrognio considerado um tim
(ENEM PPL - 2019)
O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
2 H2(g) + O2(g) → 2 H2O(g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
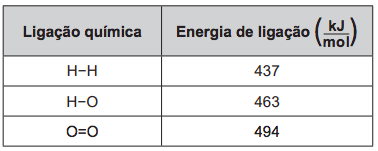
Massas molares (g/mol): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
A
−242 000
B
−121 000
C
−2 500
D
+110 500
E
+234 000


